近些年,常州大学生物医学工程与健康科学研究院欧阳明星教授团队在细胞间力学通信领域取得重要进展,揭示了细胞通过基质张应力实现远距离力学交流的分子机制,并开发了基于FRET技术的分子力学响应传感器,为解析生命组织的力学生物学规律提供了新工具。相关成果发表于《ACS Biomaterials Science & Engineering》《Frontiers in Cell and Developmental Biology》《Research》等国际权威期刊,早期成果曾被《自然·材料》(Nature Materials)和《美国科学院院报》(PNAS)专题报道,为血管发育、肿瘤转移等重大医学问题提供了新理论视角。

欧阳明星老师在实验室指导学生
随着生命科学与工程技术的深度融合,生物力学研究逐渐从单一细胞行为拓展至多细胞群体的协同作用。传统观点认为,细胞间通信主要依赖化学信号,而欧阳明星团队通过系列实验发现,细胞在三维基质中产生的收缩力可通过胶原网络形成长距离的张应力传播,诱导周围细胞定向迁移并形成稳定分枝结构。这一发现证实力学信号可在组织尺度上协调细胞行为,为理解器官形态构建提供了关键线索。 团队进一步揭示了力学信号转导的核心分子机制。他们首先揭示了α-Catenin的双重调控作用:作为力敏感分子,α-Catenin通过调控黏着斑形成,介导细胞-基质黏附与力学响应,同时促进细胞间稳定连接,是分枝结构形成的关键;探索了Piezo1通道的力学解码功能:通过研究证明机械门控离子通道Piezo1可感知基质张应力,触发钙离子内流,驱动细胞定向迁移。抑制Piezo1活性后,细胞力学响应能力显著下降,证实其在长程力通信中的关键作用。 基于上述机制,欧阳明星团队提出基于“力-生物学耦联”理论的解释:细胞通过收缩力改造基质力学环境,邻近细胞通过整合素、钙黏蛋白及Piezo1等分子感应张应力变化,最终形成自组织的多细胞结构。该理论为哮喘气道重塑、肿瘤侵袭等病理过程中异常力学信号的干预提供了新靶点。
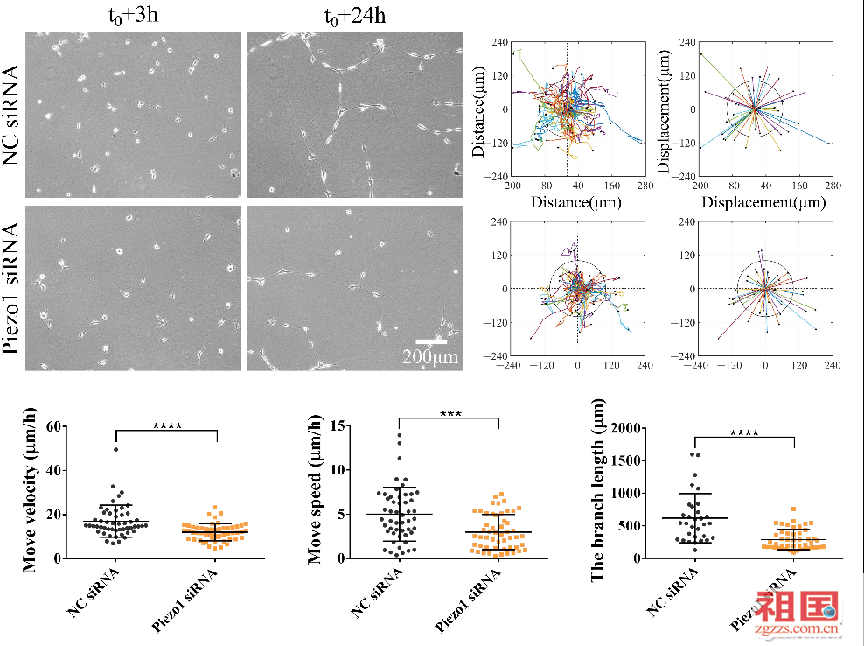
Piezo1调节细胞间的定向迁移和稳定分枝形成
欧阳明星教授深耕荧光共振能量转移(FRET)技术多年,其研发的FRET分子探针为实时监测力学信号转导提供了高灵敏度工具。在血管性血友病因子(vWF)研究中,团队设计了一种膜锚定FRET传感器,首次揭示了vWF对剪切力的两级响应机制:低剪切力下,vWF的A2结构域从分子内结合中解离,FRET效率升高,有助于促进血小板募集;高剪切力下,A2结构域进一步展开,FRET效率下降,有助于触发血凝块稳定。该成果不仅阐明了微血管损伤处凝血机制的力学基础,还为开发抗血栓药物提供了思路。此外,团队开发的Piezo1-Ca?? FRET传感器,可实时监测机械力或化学激动剂诱导的局部钙信号变化,为研究心血管疾病和神经退行性病变中的机械敏感通路提供了途径。 欧阳明星教授的教育与科研生涯贯穿中西。早年于四川大学和中国科学院生物物理研究所打下扎实的生物学基础,后赴美国伊利诺伊大学香槟分校、加州理工学院等顶尖学府深造,在FRET技术和细胞力学领域积累了丰富经验。2017年,他全职加入常州大学,依托生物医学工程与健康科学研究院平台,基于跨学科团队,聚焦“长程力学作用在生理病理中的功能”这一前沿方向。 在国家级项目支持下,团队期望揭示细胞力学通信在组织形态发育、肿瘤转移等过程中的核心作用,并探索将其应用于气道过度收缩(哮喘)和组织工程中的管状结构构建。欧阳明星强调:“力学不仅是生命的‘背景板’,更是调控细胞命运的‘指挥棒’。”欧阳明星教授的研究突破了传统生命科学的化学信号范式,将力学因素提升为解释复杂生命现象的核心维度。其团队提出的“长程力作用”理论,为组织工程、疾病治疗和仿生材料设计提供了全新框架。 “科学的价值在于服务人类健康,”欧阳明星表示,在“健康中国”战略指引下,团队将不断创新突破,攻克疾病治疗与组织修复中的力学难题,为全球生命科学发展贡献中国智慧。
责任编辑:赵娜

